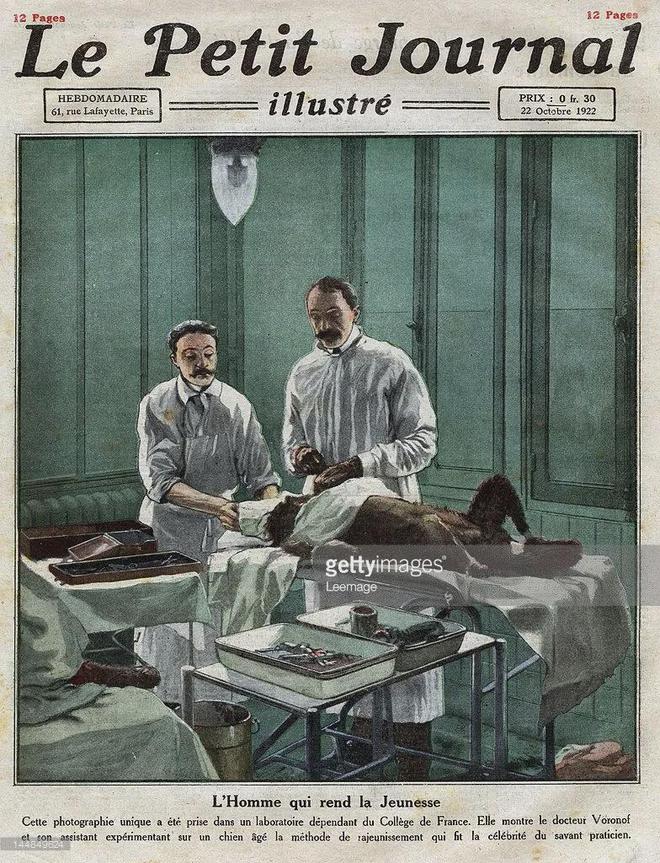
1920年6月12日,对于俄罗斯裔法国医生谢尔盖·沃罗诺夫来说,是个大日子,因为他即将为客户——一名百万富翁做一场前无古人的“返老还童”手术。
那只黑猩猩已经被助手麻醉,沃罗诺夫靠着自己精湛的刀法,将黑猩猩的睾丸取出,然后切成几毫米的薄片。
同样被助手麻醉的客户就躺在旁边,沃罗诺夫看了眼,随即就将他的阴囊割开,将切好的猩猩“丸片”植入了其中……
客户在之后声称:自己好像变了一个人,记忆更好了、腿脚更麻利了、还有那方面也勃勃生机万物竞发了……实验大获成功!自此之后,世界各地的大富翁们争相申请进行这项手术。

不知真假的实验前后照片
面对雪花般撒来的订单,沃罗诺夫在高兴的同时也有些头疼。
为啥?因为他没有足够多的猩猩。
一番思索后,沃罗诺夫意识到,既然猩猩的丸片能用,人的肯定也行!之后,他便去打通政府的关系,获得了被处决的年轻罪犯的身体使用权。
准确点说,是那个地方的使用权。
于是,又有一批客户接受了沃罗诺夫的返老还童手术——2.0版本。而结果是,口碑爆炸,又成了!

此后,海啸般的订单扑面而来,这让沃罗诺夫再次发愁:再这样下去,天天处决也不够啊!
好在天无绝人之路!沃罗诺夫想到了一个终极解决方案:既然人和猩猩的丸片都能用,同为灵长类的猴子肯定也行!
于是他在靠近法国的意大利里维埃拉海岸边开设了一个猴子养殖场,专门为他在巴黎的手术服务,即3.0版本的返老还童手术。
据统计,在此后的十多年里,有数千名富翁如愿以偿地植入了原本身强力壮的灵长类动物(包括人类)的丸片,而这也让沃罗诺夫赚得盆满钵满。
江湖上充斥着沃罗诺夫高超医术的妙手传说:有人为他写诗,有人为他创作舞台剧,上流社会的女人们讨论起他,也希望能获得重返青春的能力。

这不禁让我陷入沉思,难道一百多年前的“古人”已经熟练地掌握了异种生物间的器官移植?
01
2024年3月10号,中国人民解放军空军军医大学西京医院的研究人员历时9个小时,将一只O型血、重23公斤的巴马迷你猪的肝脏摘出后,移植到了一个被确认为脑死亡的颅脑损伤患者体内。
术后24小时,受体患者的血流动力学平稳、移植肝脏胆汁分泌良好、移植肝脏穿刺病理显示未见排斥反应!
这标志着人类首次将异种生物的肝脏移植到人体内并实现正常运作。
截止到3月21日,这枚猪肝脏已经在该患者体内工作了10天以上,《自然》杂志还发文《首例猪肝移植人体后存活10天》报道了此次事件。

可以说,任何一项与器官移植有关的重要成果都会登上科技新闻的头版头条,因为它实在是太重要了。有太多病人,只有通过更换器官才能继续生存下去,但供受体比例的严重失衡致使大量病人只能靠暂时的辅助治疗来维持生命。
据统计,中国每年有数十万人经历肝衰竭,但2022年只有约6000人找(排)到了合适的供体,接受了肝脏移植。
美国有近90000人等待肾脏移植,每年有超过3000人在等待期间死亡。
此外,心脏、脾脏、肺、眼角膜乃至皮肤等器官都有大量的移植需求。

因此,找到合适的、足量的供体器官便成了医学家们首先要解决的问题——就像百年前的沃罗诺夫所面临的那样。
不同的是,沃罗诺夫的解决办法是养猴子,现代医学可不能那么儿戏。
人类之间的输血还得考虑血型呢,更何况沃罗诺夫的手术中连双方的物种都不同!
事实上,到了1940年代,沃罗诺夫的骗局就被戳穿了,他所声称的“返老还童”根本没有任何作用,而那些接受手术的富豪们之所以夸赞手术有奇效,只是单纯的安慰剂效应。
这种安慰来自于下体的异样,即那些被植入他们体内的猩、猴丸片被免疫排斥所出现的奇怪现象(例如形成疤痕组织)。
02
人类供体的数量不足,便只能寄希望于其他动物。
实际上,在沃罗诺夫的返老还童手术之前,将其他动物的器官移植到人体内的技术已经被研究了很多年。
早在19世纪下半叶,欧洲就流行一种皮肤整形技术——将动物的皮肤取下,紧紧贴在患者有问题(如溃烂)的皮肤表面。
被用作皮肤供体的动物多种多样,包括绵羊、兔子、狗、猫、老鼠、鸡和鸽子,但最受欢迎的还得是青蛙——因为它的皮肤最是娇嫩。

医生称动物皮肤会被患者的身体吸收融合,但自始至终,没有一例手术被宣布成功。
1905年,法国医生Princeteau将一只兔子的肾取出切片后,插入到了一名肾功能不全的儿童的被切开的肾脏中。
Princeteau在笔记中写道:“手术效果立竿见影,儿童的尿量增加了、呕吐停止了……但几天后,这名儿童死于肺充血。”
次年,法国医生Jaboulay又尝试将猪和山羊的肾脏移植到了两名患者体内,但最终失败于血栓的形成。

很明显,过去的人们对免疫系统的认识不足,本着缺哪补哪、哪坏换哪的原则,便做出了不少大胆粗暴的移植手术。
而由此导致的持续失败逐渐磨掉了人们的耐心,在很长一段时间里,学界不再关注这方面的研究。
直到上世纪五、六十年代,随着免疫科学的发展以及免疫抑制药物的发现,异种器官移植失败的原因也逐步被揭开。
动物的异种器官在植入人体后,有可能会触发包括超急性排斥、急性血管排斥、细胞排斥等类型的排斥反应。
其中超急性排斥在移植后数分钟至数小时内就会出现,而且反应剧烈,急性血管排斥则通常在移植手术后的2—3天内发生。
这两种排斥源于宿主物体内天然存在的一种名为异种反应性天然抗体(xenoreactive natural antibodies,XNAs)的物质。
这种XNAs抗体识别的对象,是一种由α-半乳糖基转移酶产生的叫做α-Gal的聚糖,存在于器官内皮细胞。
大多数非灵长类动物都含有这种酶,而灵长类动物恰恰没有,因此,当XNAs识别到(非灵长类)供体器官上的α-Gal聚糖后,会把它识别为外来物。免疫系统随之激活并造成器官内皮损伤、炎症、血栓乃至器官坏死。
而细胞排斥的来源是一种叫做自然杀伤(NK)细胞的免疫细胞。
不同于T、B淋巴细胞,自然杀伤细胞不需要预先获取抗原信息,就能无差别杀伤肿瘤细胞和病毒感染细胞,它们会在异种移植器官中积聚并造成器官损伤。
当时,科学家已经研发出了几种免疫抑制药物,如硫唑嘌呤、放线菌素C、类固醇等,利用它们可以抑制巨噬细胞和NK细胞的活化,此外,还可以使用合成凝血酶抑制剂来调节血栓形成。
说实话,这些药物离完全抑制这些排斥反应的目标还很远,但新一轮的实验还是开始了。
03
1963年11月至1964年2月期间,美国杜兰大学的医生对六名晚期尿毒症患者进行了肾脏移植手术,为了最大限度地抑制免疫排斥反应,供体器官全部来自与人类亲缘关系最近的黑猩猩。

同时,在移植手术前后,所有患者均接受了硫唑嘌呤、放线菌素C、类固醇等免疫抑制药物治疗。
作为一轮探索性质的手术,最终结果是,大多数患者在4到8周内死亡,原因是后续出现的免疫排斥,或者因感染所导致的急性并发症。
但在这些患者中,有一名女性创造了异体器官移植存活时间的世界纪录。她在手术后活了9个月,还回到了学校当老师,直到某天突然死亡。
尸检结果显示,植入她体内的猩猩肾脏看起来一切正常,没有出现急性或慢性排斥的迹象。有人认为她死于急性电解质紊乱,但没有最终定论。

植入她体内的黑猩猩肾脏
虽然效果不尽理想,但从历史发展的维度看,这批肾脏移植手术是具有里程碑意义的。虽然接受手术的患者没有实现逆天改命,但它们让人类看到了希望——异种器官移植是能成的!
之后,又有医生尝试将黑猩猩、狒狒的心脏移植到患有心脏疾病的患者体内,不过,由于这两种动物的心脏明显小于人类,植入心脏的患者在出现免疫排斥反应之前,就死于了供血不足。
这时,科学家们开始思考一个更为现实的问题:到底哪种动物才是最合适的器官供体。
黑猩猩与人类最为相近,但它毕竟是一种受保护的濒危动物,过去做些探索性的实验无可厚非,但要想满足全人类的需求,哪怕它亡族灭种都不够。
其他灵长类动物如猴子、狒狒与人类的亲缘关系更远,且体型相较成年人太小,器官无法满足人体需求。另外,虽然它们不是濒危物种,但毕竟是灵长类动物,因此还存在伦理方面的担忧。

经过一番对比,科学家最终还是将目光锁定到了那个哼唧哼唧的动物——猪的身上。
猪猪那么可爱,为什么要伤害猪猪?
没办法,猪作为供体动物优势太大。
猪的养殖成本低、后代多、繁殖快,最重要的是,它的器官大小和人的十分接近,仿佛就是天选的器官供体。
此外,由于与人的亲缘关系相对较远,猪所携带的很多传染病不会发生跨物种的传播。

不过,同样也由于很远的亲缘关系,猪的器官在植入人体后会出现更强烈的免疫排斥问题——这是个要命的问题,但幸运的是,人类在一条关键的赛道上,点亮了科技树,那就是基因编辑技术。
2012年,加州大学伯克利分校的珍妮弗·杜德娜博士,在前人研究的基础上,开发出了CRISPR-Cas9基因编辑技术,利用在细菌和古细菌中发现的一种天然免疫机制,它可以精准高效地向生物的DNA中插入或者敲除一段基因,从而实现精准基因编辑。
珍妮弗·杜德娜博士也因此获得了2020年的诺贝尔化学奖。
刚才我们提到,非灵长类动物体内的α-Gal聚糖会被人类视为外来抗原。因此,只要将猪本身的α-半乳糖基转移酶基因敲除掉,就能最大程度地降低排斥反应。
此外,还可以通过插入与半乳糖基转移酶竞争的H-转移酶(岩藻糖基转移酶,会使α-半乳糖基转移酶的表达降低70%)基因、人类补体调节蛋白(CD55、CD46和CD59)基因等操作来进一步抑制免疫反应等。
再结合更多的免疫抑制药物,就使猪到人的器官移植慢慢成为了现实。
2021年9月,纽约大学朗格尼医学中心的外科医生对一名脑死亡的患者进行了首例经过基因编辑的猪肾脏移植手术。
基因编辑操作是将供体猪的半乳糖基转移酶基因敲除,如前文所说,该基因表达所生成的α-gal聚糖会在人体内诱发免疫排斥反应,有些人就因为对该聚糖极度敏感,导致不能吃猪肉。

在该手术完成后的54小时内,没有观察到排斥反应。
2022年1月,美国马里兰大学的医生对一名57岁的心脏病患者进行了首例经过基因编辑的猪心脏移植手术。
基因编辑的操作同前例一样。两个月后,该患者去世,但医生没有公布他的具体死因。
2024年1月,美国宾夕法尼亚大学的外科医生首次将经过基因编辑的猪肝脏与一名脑死亡的人体在体外相连,成功过滤血液72小时。

到了3月,前文提到的,我国西京医院的专家就将一只经过基因编辑的猪的肝脏移植到了一名脑死亡者的体内。根据官方发布的消息,这颗肝脏至少已经正常工作了10天。
尾声
2024年3月16日,在西京医院的肝脏移植手术完成后一周,美国一位62岁的终末期肾衰竭患者Richard Slayman在麻省总医院接受了猪肾脏移植手术。

梅丽莎·马托拉·基亚托斯从盒子里取出一个猪肾准备移植。(图片来源:马萨诸塞州总医院)
由此,他成了世界上首个植入基因编辑猪肾脏的活人。
为了最大程度地保障Slayman的术后安全,提供技术支持的eGenesis公司利用CRISPR–Cas9技术,对那只供体猪做了多达69次基因编辑,创下了世界纪录。

这些编辑中有10种是为了避免异体器官导致排斥反应,另外59种则是为了灭活猪基因组中嵌入的病毒,降低潜伏在器官中的病毒感染接受者的风险。
如今,Slayman正在同步接受免疫抑制药物的治疗,截止到3月25日,还没有出现器官排斥的迹象。
不过,即便他能安全度过超急性排斥、急性血管排斥、细胞排斥等过程,还存在一种慢性排斥反应阶段。
慢性排斥被发现在同种器官移植也就是比如人对人的器官移植过程中,它会导致器官发生病理变化比如动脉硬化,这也是为什么移植器官很多时候需要在多年后更换的原因。
当然了,对于异种器官移植的病人和医生来说,慢性排斥算是幸福的烦恼了,毕竟之前都度不过急性排斥阶段嘛,我们可以在真正遇到它时,再做打算。
Slayman能创下异体器官移植存活时间的新纪录吗?只能等待时间来告诉我们答案。
但无论结果如何,相比于1838年,美国医生Kissam做的人类史上第一例猪到人的器官(眼角膜)移植手术,我们已经往前走了很远。
或许,一个器官移植再也不用排队的时代,正在到来。
来源:酷玩实验室 微信号:coollabs

 微信扫一扫打赏
微信扫一扫打赏 支付宝扫一扫打赏
支付宝扫一扫打赏





